 Статьи
Статьи
|
Фосфаты

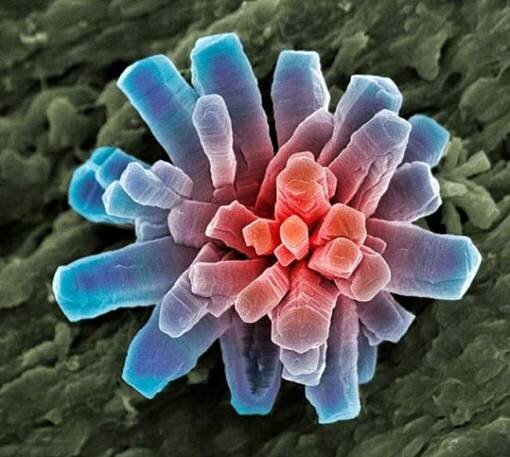
Фотография кристалла фосфата.
ФОСФАТЫ НЕОРГАНИЧЕСКИЕ, соли кислородных кислот фосфора в степени окисления +5 (см. Фосфора кислоты). Существуют ортофосфаты - соли ортофосфорной кислоты H3PO4 и фосфаты конденсированные - соли полифосфорных кислот. Различают средние, кислые и основные фосфаты, разнокатион-ные (двойные и тройные соли) и разноанионные (смешанные соли), оксифосфаты, а также различные неорганическое производные (например, тиофосфаты). Анионы ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. построены из тетраэдров PO4 с атомами О в вершинах. Ортофосфаты состоят из изолирован ных тетраэдров, в конденсированных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. тетраэдры связаны в кольца или цепочки через общие вершины.
Кислые ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. образуются в результате частичной нейтрализации H3PO4 или полифосфорных кислот основаниями. При полной нейтрализации гидроксидами одного или несколько металлов получают средние ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н.- соответственно одного металла или двойные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. Смешанные соли образуются при нейтрализации смеси кислот, например ди- и трифосфорных, одним гидроксидом (ординарные разноанионные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н.) или несколько гидроксидами (разнокатионно-разноанионные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н.). Нейтрализующим агентом служит и NH3. Конденсированные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. получают также термодинамически обработкой кислых ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н., смесей ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. При этом состав исходного продукта (в пересчете на оксиды)

должен отвечать составу синтезируемого соединения (О < R 3). В области значений 3 < R
3). В области значений 3 < R 8 получают оксифосфаты. Характеристики некоторых ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. приведены в таблице.
8 получают оксифосфаты. Характеристики некоторых ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. приведены в таблице.
Ортофосфаты встречаются в природе в виде минералов (известно около 190), важнейшие из них - апатит и фосфориты (см. также Фосфор).
Средние ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. Общее свойство безводных солей - стабильность при нагревании до температуры плавления. Ортофосфаты МII3(РО4)2 плавятся при 1375 (M = Mg), 1777 (Ca), 1600 (Sr), 1605 (Ba), 1152 (Mn), 1345 (Ni), 1060 (Zn), 1014 0C (Pb), дифосфаты MII2P2O7 - при 1382 (Mg), 1355 (Ca), 1375 (Sr), 1430 (Ba), 1195 (Mn), 1400 (Ni), 1020 (Zn), 830 0C (Pb). Исключение составляют неустойчивые ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. (с катионами NH+4, Hg2+), например Hg3(PO4)2, из которого часть ртути улетучивается ниже температуры плавления. В противоположность ортофосфатам конденсированные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. Pn при плавлении превращаются в фосфатные смеси Рт.
Кристаллогидраты многие ортофосфатов и некоторых конденсированных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. при нагревании теряют кристаллизационную воду ступенчато без изменения состава аниона. На этом свойстве основан топохимический способ синтеза безводных солей, которые не удается получить др. способами. Так, топохимический путем из (NH4)5P3O10•хH2O, где х=I, 2, в среде газообразного NH3 получен кристаллич. (NH4)5P3O10. Средние ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. металлов в высоких степенях окисления не растворим в воде, щелочных металлов и аммония - раств., их водные растворы имеют рН > 7. Анионы конденсированных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. не стабильны в водных растворах, они последовательно превращаются в анионы низших ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н.
Кислые и основные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. Растворимость в воде кислых и основных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. выше, чем у средних, в раствор переходят даже некоторые соли металлов в высоких степенях окисления. Благодаря этому свойству кислые ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. используют в качестве удобрений. При рН < 7 сложные анионы быстрее разлагаются до простых (по сравнению с рН > 7). При нагревании в результате конденсации кислые соли меняют анионный состав ниже температуры плавления, благодаря чему они служат исходными соединение для получения многие конденсированных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н.
Помимо гидро- и дигидроортофосфатов щелочных металлов известны кристаллич. кислые ортофосфаты: MIIHPO4, где M = Be, Mg, Ca, Sr, Ba, Mn, Zn, Cd, Sn, Pb, Hg, их кристаллогидраты с одной молекулой воды (M = Be, Mg, Cu, Zn), двумя (Ca, Со, Ni), тремя (Mg, Mn, Zn) и семью (Mg); MII(Н2РО4)2, где M = Mg, Sr, Ba, Cu, Cd, Sn, Pb, их кристаллогидраты с одной молекулой воды (M = Ca, Sr), двумя (Mg, Mn, Fe, Со, Ni, Zn, Cd) и четырьмя (Mg); содержащие несколько анионных форм: Со(Н2РО4)2•2H3PO4, NaH2PO4•Na2HPO4 (используется при получении триполифосфата Na). Получены дигидродифосфаты MII2H2P2O7, где M = Ca, Sn, Ba, Mn, Fe, Со, Ni, Zn, Pb; кислые трифосфаты MI3H2P3O10•1,5H2O, где M = Na, Rb; MII2HP3O10, где M = Ca, Pb; MIIIH2P3O10, где M = Al, Cr, Fe, а также их моно-, ди- и тригидраты.
Кристаллическая тригидрофосфат K2H3P3O10•2H2O отличается от гидро- и дигидрофосфатов способностью менять консистенцию при механические активации и превращаться в пластилино-подобную массу. Эффект связан с диспропорционированием, которое в кислых солях различные металлов проявляется по-разному. При вьщерживании кристаллов MnHPO4•3H2O во влажной среде в их объеме возникают и растут жидкие и твердые включения продуктов распада исходной кислой соли на менее протонированную соль и свободную кислоту:

ХАРАКТЕРИСТИКА НЕОРГАНИЧЕСКИХ ФОСФАТОВ
|
Соединение |
R |
Сингония, пространст- венная группа |
Параметры решетки |
z |
Плотн., г/см3 |
|||||||
|
а, нм |
b, мм |
c, нм |
|
|
рентгеновская |
экспериментальная |
||||||
|
Средние соли |
||||||||||||
|
Na3PO4 • 12H2O |
3 |
Тригон., Р3с1 |
1,202 |
— |
1,266 |
— |
—
|
— |
— |
1,62 |
||
|
Zn3(PO4)2 •4H2O (гопеит) |
3 |
Ромбич. |
1,0629 |
1,8339 |
0,5040 |
— |
— — |
4 |
3,096 |
3,104 |
||
|
Zn5(P3O10)2•I7H2O |
5/3 |
Триклинная |
1,0766 |
1,0316 |
0,8525 |
111,39 |
115,08 70,19 |
1 |
— |
— |
||
|
Ca4P6O19 (тромелит) |
4/3 |
То же |
0,940 |
1,339 |
0,707 |
109,5 |
87,9 108,9 |
2 |
2,86 |
2,85 |
||
|
Mg2P4O12-I |
1 |
Моноклинная, C2/c |
1,1756 |
0,8285 |
0,9917 |
— |
118,96 — |
4 |
2,865 |
— |
||
|
|
1 |
Орторомбич., Р212121 |
0,7428 |
0,7360 |
0,8577 |
— |
— — |
4 |
3,83 |
— |
||
|
Ba2P6O17 |
2/3 |
Моноклинная, P21 |
0,7387 |
1,3311 |
0,7418 |
— |
105,56 — |
2 |
— |
— |
||
|
MnP4O11 |
1/2 |
Р21 /п |
0,8608 |
0,8597 |
1,2464 |
— |
— 97,30 |
4 |
— |
2,62 |
||
|
Кислые и основные соли |
||||||||||||
|
Na2HPO4 •2H2O |
3 |
Ромбич., Р222 |
1,034 |
1,364 |
1,698 |
_ |
_ _ |
_ |
_ |
2,066 |
||
|
MnHPO4•3H2O |
3 |
Рbса |
1,0434 |
1,0882 |
1,0219 |
— |
— — |
— |
— |
— |
||
|
Sn2PO4(OH) |
— |
P21 /n |
0,7176 |
0,7051 |
1,0453 |
— |
103,96 — |
4 |
— |
— |
||
|
Zn2HP3O10•6H2O |
5/3 |
Триклинная |
1,0714 |
1,0658 |
0,8391 |
114,51 |
103,21 74,31 |
2 |
— |
— |
||
|
Pb2HP3O10 |
5/3 |
Cm |
0,693 |
1,434 |
0,597 |
— |
135,1 — |
2 |
5,32 |
5,30 |
||
|
Разнокатионные фосфаты |
||||||||||||
|
KZn2H(PO4)2 •2,5H2O |
3 |
P1 |
0,9109 |
1,3543 |
0,8814 |
102,21 |
113,35 95,92 |
4 |
_ |
_ |
||
|
Mn2Zn(PO4)2 •4H2O |
3 |
Орторомбич. |
1,0647 |
1,8503 |
0,5066 |
— |
— — |
— |
— |
— |
||
|
Li2BaP2O7 |
2 |
Стcm |
0,7078 |
1,2164 |
1,3856 |
— |
— — |
8 |
3,62 |
3,62 |
||
|
NH4BeP3O10 |
5/3 |
Моноклинная C2/c |
1,2200 |
0,8645 |
0,8937 |
— |
117,40 — |
4 |
— |
— |
||
|
NH4Zn2P3O10•7H2O |
5/3 |
— |
1,073 |
0,8474 |
1,0725 |
65,03 |
105,94 102,90 |
2 |
2,08 |
2,14 |
||
|
Na3Mg2P5O16 |
7/5 |
Моноклинная Р2/а |
1,8617 |
0,6844 |
0,5174 |
— |
90,25 — |
— |
— |
— |
||
|
NiZnP4O12 |
1 |
C2/c |
1,1689 |
0,8277 |
0,9870 |
— |
118,55 — |
4 |
— |
— |
||
|
Ba2Zn3P10O30 |
1 |
P2/n |
2,1738 |
0,5356 |
1,0748 |
— |
99,65 — |
— |
— |
— |
||
|
[K2Pb(PO3)4]n•H2O |
1 |
Орторомбич., Рbса |
1,5467 |
1,5417 |
0,9227 |
— |
— — |
8 |
3,63 |
— |
||
|
Разноанионные фосфаты |
||||||||||||
|
K2Ni4(PO4)2(P2O7) |
3/2 |
Моноклинная |
1,820 |
1,365 |
1,031 |
— |
103,1 — |
8 |
3,61 |
3,65 |
||
|
NH4Cd6(P207)2(P3010) |
2,5/3 |
___ |
0,6785 |
0,5494 |
2,7199 |
— |
— 107,28 |
— |
4,30 |
— |
||
|
BaP2O7•B2O3 |
— |
Гексагон. |
0,7111 |
— |
1,3977 |
— |
— — |
— |
— |
— |
||
|
Оксифосфаты |
||||||||||||
|
Sr4P2O9 |
4 |
Орторомбич., P2221 |
1,257 |
0,979 |
0,738 |
— |
— — |
— |
— |
— |
||
|
Ba10O(PO4)6 |
10/3 |
— |
1,015 |
— |
0,770 |
— |
— — |
— |
— |
— |
||
|
Fe9O8(PO4) |
— |
Орторомбич., Вттт |
0,5949 |
0,3064 |
2,5694 |
— |
— |
2 |
5,14 |
5,12 |
||
|
Pb8P2O13 |
8 |
C2/m |
1,0641 |
1,0206 |
1,4342 |
— |
98,34 — |
4 |
8,306 |
8,29 |
||
Известны природные основные соли - минералы гидроксиапатит Са10(РО4)6(ОН)2, вавеллит Al3(РО4)2(ОН)3•5Н2О, бирюза СuAl6(РО4)4(ОН)8•5Н2О. Синтезированы основные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. типа Со5(Р04)2(ОН)4, Cu2PO4(OH), In2P3O10(OH)•9H2O.
Разнокатионные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. Содержат разноименные катионы металлов и аммония, например: KZn2H(PО4)2•xH2О, где х= О, 2, 5, Na2UO2HP3O10, NaPrHP3O10•3H2O, Ni[GePO4(HPO4)]2 •8H2O, а также основные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н.- минералы крандаллит СаAl3(РО4)2(ОН)5 •Н2О, миллицит (Na, К)СаAl6(РО4)4(ОН)9•ЗН2О. Встречаются в природе в виде продуктов взаимодействие анионов фосфорных удобрений и катионов почвенного поглощающего комплекса. При плавлении нейтральных конденсированных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. образуются смеси, MMP анионов которых зависит не только от R, но и от соотношения между разноименными катионами. Ортофосфа-ты  плавятся при 921 (M = Li), 1117 (Na), 885 0C (Ag); дифосфаты
плавятся при 921 (M = Li), 1117 (Na), 885 0C (Ag); дифосфаты  - при 773 (Li), 648 (Na), 680 0C (К); цикл отри фосфаты
- при 773 (Li), 648 (Na), 680 0C (К); цикл отри фосфаты  - при 735 (Li), 800 (Na), 680 0C (Ag). Одна из особенностей ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. этого типа - многообразие изоструктурных рядов с различные комбинациями разноименных катионов.
- при 735 (Li), 800 (Na), 680 0C (Ag). Одна из особенностей ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. этого типа - многообразие изоструктурных рядов с различные комбинациями разноименных катионов.
Синтез полифосфатов  из растворов солей разноименных катионов имеет специфику, связанную с возникновением вязких фаз, в которых происходит быстрая деструкция аниона. Для получения кристаллогидратов эффективен способ подбора скорости кристаллизации, превышающей скорость деструкции. T. обр. синтезированы кристаллич. NH4Mg2P3O10•6H2O, NH4Mn2P3O10•5H2O, отличающиеся по свойствам от известных аморфных соответственно гепта- и гексагидратов.
из растворов солей разноименных катионов имеет специфику, связанную с возникновением вязких фаз, в которых происходит быстрая деструкция аниона. Для получения кристаллогидратов эффективен способ подбора скорости кристаллизации, превышающей скорость деструкции. T. обр. синтезированы кристаллич. NH4Mg2P3O10•6H2O, NH4Mn2P3O10•5H2O, отличающиеся по свойствам от известных аморфных соответственно гепта- и гексагидратов.
Применяют топохимический синтез, основанный на дегидратации кристаллогидратов, взаимодействие безводных солей с парами воды, кислых солей с газообразным NH3. Аммонизацией предварительно активированного KZn2H(PО4)2•2,5H2О получена тройная соль KZn2NH4(PО4)2•0,6H2О. Безводные двойные и тройные соли обычно получают кристаллизацией из расплава или термодинамически обработкой соответствующих смесей. Так, перечисленными способами синтезированы  , где M = Li, Na, NH4;
, где M = Li, Na, NH4;  , где M = К, Rb, Cs, Tl, NH4;
, где M = К, Rb, Cs, Tl, NH4;  где M = Na, К, Cs, Ag; M1Ba2(PO3)5, где M = Li, Cs, Na3Mg2P5O16 и др.
где M = Na, К, Cs, Ag; M1Ba2(PO3)5, где M = Li, Cs, Na3Mg2P5O16 и др.
Разноанионные ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. (смешанные соли). Разноименными может быть анионы кислот фосфора (например,  и
и  ,
,  и
и  ), включая соединение P в низших степенях окисления (анионы изомеров H4P2O5), и др. кислот (
), включая соединение P в низших степенях окисления (анионы изомеров H4P2O5), и др. кислот ( и
и  ,
, и Сl-). Соли типа Rh4(HPO4)(PO4)2(H2O)12 с анионами различные степени про-тонизации относят к кислым ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н., в которых вследствие дис-пропорционирования возможно сосуществование несколько анионных форм. Кристаллическая соль NH4Cd6(P2O7 )2(P3О10) получена гидротермальным синтезом; KSr3(PO4)(SO4)2 - при нагревании смеси ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. и сульфата. Известны Ва10(РО4)бХ2, где X = F, Cl;
и Сl-). Соли типа Rh4(HPO4)(PO4)2(H2O)12 с анионами различные степени про-тонизации относят к кислым ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н., в которых вследствие дис-пропорционирования возможно сосуществование несколько анионных форм. Кристаллическая соль NH4Cd6(P2O7 )2(P3О10) получена гидротермальным синтезом; KSr3(PO4)(SO4)2 - при нагревании смеси ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. и сульфата. Известны Ва10(РО4)бХ2, где X = F, Cl;  , где M = La, Nd и др.
, где M = La, Nd и др.
Оксифосфаты  . Для этих соединение MIIO:P2O5 =10:3, 4:1, 5:1, 8:1. Получают их взаимодействие твердых или расплавленных компонентов при заданном значении R. Соли типа
. Для этих соединение MIIO:P2O5 =10:3, 4:1, 5:1, 8:1. Получают их взаимодействие твердых или расплавленных компонентов при заданном значении R. Соли типа , или
, или  , где M = Ca, Sr, Ba, образуют изоструктурный ряд с соединение
, где M = Ca, Sr, Ba, образуют изоструктурный ряд с соединение  и
и  . В оксифосфате Cu4P2O9 структурный каркас образован параллельно ориентированными слоями атомов Cu и О, между к-рыми расположены атомы P. Оксифосфаты высокоплавки, например Sr4P2O9 плавится при 1600 ?С, Сu5О2(РО4)2 - при 920 0C. В системе K3PO4-MgO выделен K6MgP2O9, или 2K3PO4•MgO, с температура плавления 1570 0C.
. В оксифосфате Cu4P2O9 структурный каркас образован параллельно ориентированными слоями атомов Cu и О, между к-рыми расположены атомы P. Оксифосфаты высокоплавки, например Sr4P2O9 плавится при 1600 ?С, Сu5О2(РО4)2 - при 920 0C. В системе K3PO4-MgO выделен K6MgP2O9, или 2K3PO4•MgO, с температура плавления 1570 0C.
Неорганические производные ФОСФАТЫ НЕОРГАНИЧЕСКИЕн. Замещением в конденсированных ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. концевых атомов О атомами S получают тиофосфаты, например монотиотрицикло-фосфат Na3P3O8S• 6H2O, тетратиотетрациклофосфаты MII2P4O8S4• 10H2O, где M = Sr, Ba, а присоединением групп SO3 к концам цепи - сульфатофосфаты формулы I, где M = Na, n — 3-25. При замене мостиковых и концевых атомов О ионов P3O5-10 соответственно амидо- и имидогруппами образуются ионы дии-мидо-(П) и амидоимидотрифосфаты (Ш). Известны силика-то-, хромато-, ванадато- и арсенатофосфаты типа Na3H2(P, As)3O10 (IV) и др. Фторотрифосфат-ион (V) благодаря смещению положит, заряда рециклизуется при рН > 7 с образованием трициклофосфат-иона.

О применении ФОСФАТЫ НЕОРГАНИЧЕСКИЕ н. см. Алюминия фосфаты, Аммония фосфаты, Железа фосфаты, Калия фосфаты, Натрия фосфаты, Фосфорные удобрения и др. Oo эфирах фосфорных кислот см. Фосфаты органические.
Литература: Самускевич В. В. [и др.], "Изв. АНБССР. Сер.химический наук", 1984, № 1, с. 47-51; № 2, с. 41-46; Продан E.А., Неорганическая топохимия, Минск, 1986, с. 52-72; Констант З.А., Диндуне А. П., Фосфаты двухвалентных металлов, Рига, 1987; Щегров Л. H., Фосфаты двухвалентных металлов, К., 1987; Melloг J., Comprehensive treatise on inorganic and theoretical chemistry, v. 8, suppl. Ш, N. Y., 1972, p. 1467. Е. А Продан.
Дополнительно по данной категории

|
07.06.2012 - Финансовая пирамида |

|
30.11.2011 - Фотография |

|
19.11.2011 - Файл |

|
21.02.2011 - Фотосток |

|
26.09.2010 - Фрегат 11356 |
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||
|
||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||
|
||||||||||||
|
||||||||||
|
||||||||||||
|
||||||||||||
|
||||||||||
|
||||||||||||
|
||||||||||||
|
|

























 , град
, град град
град град
град [Cd(PO3)2]n•H2O
[Cd(PO3)2]n•H2O


